السلام عليكم و رحمه الله و بركاته
شحالكم اخوااني
لو سمحتو حبيتكم تساعدوني ف بحث ماده الكيميا
انا ما ابغيكم تعطوني البحث لكن ابغي مواقع تساعدني في اجراء البحث و معلومات كذلك
لأني بصراحه دورت و ما حصلت
هناك 4 مواضيع اختار واحد منها
و لم اجد ايه معلومات عن واحد منهاا
الموضوع الأول:لا تحتوي لافتات النيون على غاز النيون دائما الأضواء ذات الألوان المختلفه الصادرة
من هذه اللافتات تكون نتيجه انبعاث أشعه ناتجه عن غازات تحت ضغط منخفض في انابيب مختلفه ابحث عن الغازات الأخرى المستخدمه في لافتات النيون و عدد الألوان التي تصدر عن هذه الغازات.
هذا الموضوع لم ابحث فيه
اكتب تقريرا عن التأثير الكهروضوئي موضحا بعضا من استعمالاته العلميه و اشرح العمليه الأساسيه لكل من التقنيات المذكووره<<<<بحثت و لم اجد للأسف





 اضافة رد مع اقتباس
اضافة رد مع اقتباس

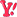
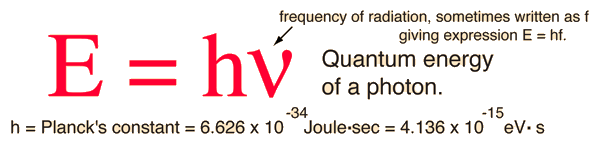












المفضلات